蒽环类药物可以单独应用也可以与靶向药物或者细胞毒药物联合应用,是治疗多种血液学和实体瘤最常用的抗肿瘤药物。如阿霉素(doxorubicin, DOX)及其衍生物表柔比星被广泛应用于乳腺癌、子宫内膜癌、胃癌、儿童实体瘤、软组织肉瘤和侵袭性淋巴细胞或骨髓细胞白血病。使用蒽环类药物与剂量有关(表1),蒽环类药物导致的心脏毒性往往呈进展性和不可逆性,特别是初次使用蒽环类药物就可能造成心脏损伤,因此早期监测和积极预防蒽环类药物引起的心脏毒性显得尤为重要。DOX可以对多种心脏细胞产生损伤(图2),以下机制以心肌细胞为例。

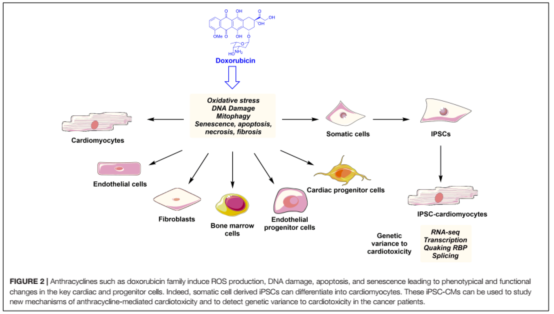
1.蒽环类药物心脏毒性的机理
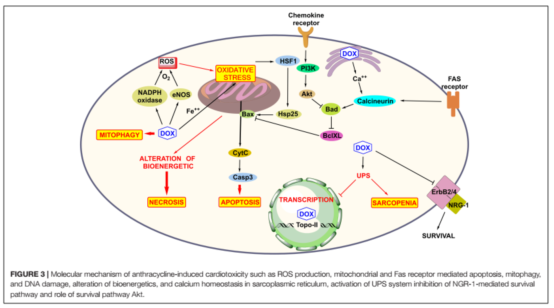
DOX介导的心脏毒性机制已被相当清楚(图3)。这一机制已经被广泛研究了50多年,包括(1)氧化应激和生成活性氧;(2)拓扑异构酶II的抑制和双链DNA断裂导致的转录基因改变与细胞凋亡;(3)线粒体功能损伤,从而激活细胞凋亡通路。此外心脏毒性还与高能磷酸盐池的变化、肾上腺素能通路的异常相关。
1.1氧化应激的作用
氧化应激是DOX介导的心脏毒性研究最广泛的机制。它源于活性氧(ROS)以及活性氮(RNS)产生的不平衡,和与其他器官相比心脏内抗氧化剂相对较低水平的机制。线粒体ROX的产生主要是由于催化蒽环类氧化还原循环产生,DOX可以结合在内皮细胞特异性的一氧化氮合成酶(eNOS)的还原酶区域,导致氧自由基和超氧化合物的增加,NO合成减少。当线粒体内阿霉素的浓度超过50-100µM, ROS水平开始明细增加。阳离子药物DOX吸引了位于线粒体内膜内的一种负电荷磷脂——心磷脂。心磷脂参与氧化磷酸化过程,在线粒体依赖性凋亡通路中起重要作用。DOX与心磷脂形成不可逆复合物,也容易受到ROS的过氧攻击。心磷脂过氧化导致(i)细胞色素c从线粒体膜分离,导致caspase依赖性凋亡,(ii)解开线粒体呼吸链复合体i、III和IV,形成线粒体渗透过渡孔(mPTP)。mPTP与Bcl-2家族蛋白相关,导致使用ATP减少,与线粒体和细胞质肿胀相关,从而导致细胞坏死。急性阿霉素诱导心脏毒性时发生坏死。DOX介导的ROS激活热休克因子(HSF)-1,增加热休克蛋白(Hsp25)的表达,使肿瘤抑制蛋白p53发生突变,从而改变Bcl-2和促凋亡Bax的水平。
铁-DOX诱导ROS形成的氧化应激起次要作用。阿霉素几经氧化还原过程,形成半醌代谢物或阿霉素醇,形成含铁的化合物,导致 O2− 和H2O2产生增加,诱导细胞凋亡。DOX介导的铁在心肌细胞的积累比铁-DOX复合物更有害。阿霉素调节ATP结合盒(ABC)B8蛋白(一种线粒体铁输出蛋白),导致蛋白减少,从而使得线粒体中输出铁的过程受阻。细胞内铁稳态是由铁反应元件(IREs)和铁调节蛋白(IRPs)来平衡的。高铁细胞水平促进[4Fe-4S]簇的组装,诱导IRPs的活性,并消除其与IRE的结合。阿霉素或其代谢物从[4Fe-4S]簇中去除Fe2(+)的表达,从而增强其铁摄取蛋白质、转铁蛋白mRNA的稳定性,并阻止铁螯合蛋白、铁蛋白的翻译。因此,DOX通过改变蛋白质的运输促进细胞内铁的积累和减少铁的亚细胞细胞器释放,导致细胞内铁过载。
1.2 其他相关机制
DOX可以抑制拓扑异构酶2 (Top2),通过形成一个共价的Top2 -DOX-DNA复合物(裂解复合体),导致双链DNA断裂。Top2由同功酶Top2α和Top2β。在G2/M期Top2α高度表达在增殖(恶性和非恶性)细胞。它是染色体分离的必要条件。DOX化疗显示出很高的疗效,因为Top2α在癌细胞是上调表达的。然而,在成年人的静止心肌细胞Top2β尤为丰富且不断表达。阿霉素通过Top2β插入心肌细胞DNA并产生毒性。DOX可以促进心肌细胞有丝分裂,使得心肌细胞线粒体通透性增加,心肌细胞急性损伤,引起细胞坏死。DOX促进免疫细胞如NK细胞、T细胞、巨噬细胞的分化,死亡相关受体蛋白的表达增加,诱导细胞凋亡。
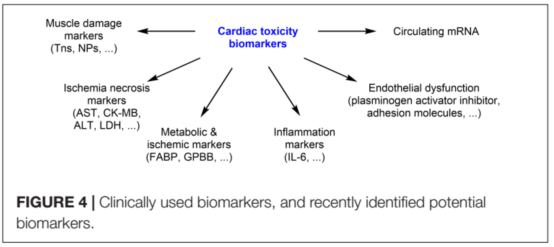
2. 蒽环类药物介导的心脏毒性监测标记物
评估和监测抗癌药物诱导心脏毒性主要的心脏生物标志物是利钠肽(NPs)
和肌钙蛋白(Tns)。Tns是心脏损伤的标志,而NPs是体积扩大和心室增大的压力标志。最近有研究发现潜在的生物标志物(图4)。炎症相关标志物(高敏c反应蛋白、白介素-6)、内皮功能障碍(纤溶酶原激活抑制剂、可溶性细胞间粘附分子)、心肌缺血(脂肪酸结合蛋白、糖原磷酸化酶)和NRG-1等生物标志物也被认为是心脏毒性的诊断标志物。一些心脏miRNA(如。miR-208、miR-1和miR-133)也与DOX心脏毒性有关,但这些数据需要进一步验证。也有报道在蒽环类化疗后,心肌缺血/坏死相关标志物水平升高如血清心肌酶[aspartateaminotransferase (AST),肌酐激酶(CK-MB),乳酸脱氢酶(LDH),丙氨酸转氨酶(ALT)]。
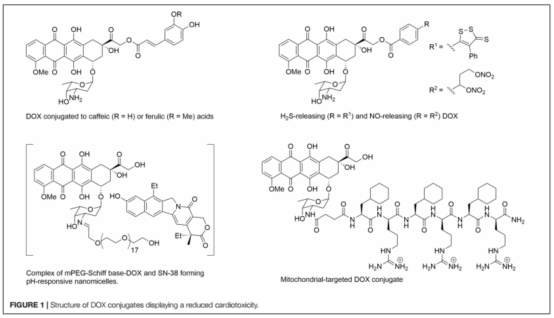
3.降低蒽环类药物心脏毒性的策略
3.1 研发新的蒽环类药物
近年来,研究集中在开发新的DOX结构药物,以减少心脏毒性,而不改变其对癌细胞的细胞毒性效力。为了延长循环水平和控制DOX的释放,已经引入了脂质体DOX 。聚乙二醇脂质体 DOX (PEG-DOX)被发现具有非常长的循环时间,但它对皮肤有很高的亲和力。非peg脂质体DOX (MyocetT)也得到了开发。MyocetT与表柔比星(表1)具有相似的心脏毒性。另一种降低DOX介导的心脏毒性的方法是使用具有心血管保护作用的药物(图1)。例如,与DOX相比,将DOX与咖啡因和阿魏酸等抗氧化剂结合可以降低毒性。或NO供体(NitDOX)可释放硫醇和NO,降低体内心脏毒性。另一种方法是将DOX与改变药物药理分布的载体结合,从而降低药物在心脏中的水平,并将DOX靶向传递到肿瘤细胞。由mPEG-Schiff base-DOX和7-乙基-10-羟基喜树碱(SN-38)组成的纳米粒,不仅可以根除乳腺癌干细胞,而且可以提高肿瘤部位的药物积累效率,副作用更小,对心脏、肝脏、脾脏、肺、肾没有明显的毒性。将DOX与线粒体穿透肽结合产生一种称为线粒体靶向DOX(线粒体靶向DOX, MtDOX)的化合物,该化合物可以通过激活线粒体代偿性生物发生,而使心肌细胞从线粒体损伤中恢复,而不会引起与心脏毒性有关的核损伤。虽然MtDOX在药物敏感细胞中细胞毒性较小,但在耐阿霉素细胞中表现出较强的细胞毒性作用。
3.2 预防蒽环类致心脏毒性药物
地塞米松,血管紧张素转换酶(ACE)抑制剂,β-受体阻滞剂已经被提议作为预防策略,目前尚无足够临床依据证明疗效。铁螯合剂如右旋拉唑烷已经被证明可以与人类Top2α和Top2β的atp酶结构域结合,防止蒽环类Top2绑定,从而预防蒽环类药物心脏毒性。右旋拉唑烷的一个重要缺点是具有致癌潜能,发展为急性髓系白血病和骨髓增生异常综合征风险增加。因此在欧洲,它的使用在儿童是禁忌的,欧洲药品管理局(EMA)和FDA仅限于晚期或转移的成人患者。目前,新型的心脏保护药物对保护和治疗心脏毒性有极大的兴趣。例如褪黑激素的拮抗剂和大麻素CB1受体具有对抗阿霉素诱导的心脏毒性。红细胞生成素也有心血管保护作用,抗蒽环介导的心脏毒性作用。
作者:中山大学附属第七医院肿瘤科朱梦媛



