北京时间9月24日,国际顶尖学术期刊《自然》(Nature)刊发中山大学附属第七医院(简称中山七院)张常华教授团队联合中山大学物理学院物理力学与生物物理研究中心林绍珍教授、英国癌症研究院Axel Behrens院士团队的重要研究成果。(请点击链接查看全文:https://www.nature.com/articles/s41586-025-09574-y。)

研究成果在Nature刊发
该研究面向“癌王”胰腺导管腺癌(PDAC),首次系统揭示了骨桥蛋白(SPP1)为核心的信号通路在调控肿瘤细胞命运转换中的关键作用,并在动物模型中验证了靶向该蛋白逆转肿瘤恶性进展的有效性,为胰腺癌的精准治疗提供了新范式。
“癌王”胰腺癌的致命开关,被中山大学专家团队精准锁定!
胰腺导管腺癌是预后最差的恶性肿瘤之一,患者五年生存率不足5%,其高度异质的肿瘤微环境是治疗面临的主要挑战。肿瘤中存在上皮样和间质样两类细胞亚群,后者是导致转移与耐药的关键。尽管团队早期研究已揭示间质细胞分泌的GREM1蛋白可影响上皮细胞状态,但驱动间质细胞命运的上游信号始终未知。
为解决这一难题,研究团队整合临床样本多组学分析与基因工程动物模型,成功绘制出以SPP1为核心的细胞间对话网络。研究发现,上皮肿瘤细胞分泌的SPP1作为关键信使,激活间质细胞表面CD61受体,进而启动BMP2-GREM1信号轴,形成双向调控回路。SPP1、BMP2与GREM1三者构成动态平衡分子网络,共同决定肿瘤的侵袭特性。
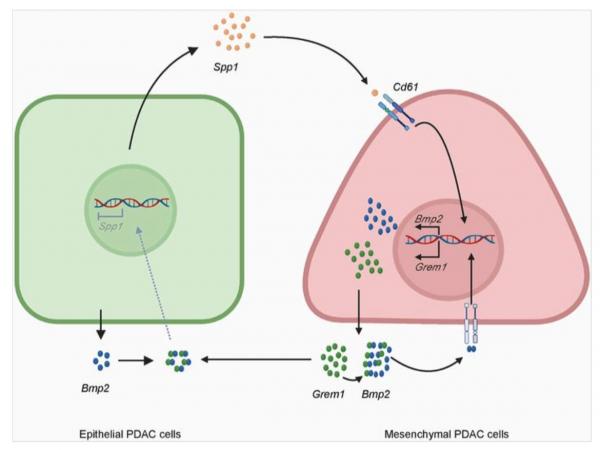
机制示意图
研究进一步在模拟人胰腺癌特征的基因工程小鼠模型中证实,使用靶向Spp1的单克隆抗体进行治疗,可显著抑制肿瘤生长与远处转移,延长生存期,展现出良好的临床转化前景。
本研究融合了临床医学、生物物理学与分子生物学等多学科优势,突破单一领域的认知局限,通过精巧的实验设计与模型构建,阐明了胰腺癌细胞命运的核心调控机制。这不仅深化了对胰腺癌生物学的理解,也为未来开发新型治疗策略提供了重要理论与实验依据。
英国癌症研究院终身高级科学家(Staff scientist)李华福博士,中山大学附属第七医院蓝林祥研究员和中山大学附属第七医院陈恒星特聘研究员为共同第一作者;张常华教授和Axel Behrens院士为通讯作者。研究得到国家自然科学基金和广东省消化系统恶性肿瘤防治研究重点实验室等基金的资助。
---中山大学附属第七医院---
文 | 蔡楠、郭俊逵
编辑 | 李欣煦
初审 | 张常华、李华福
审核 | 江清浩、刘冉冉
审核发布 | 温光浩



